
【執筆・監修】 阿部 博幸
東京キャンサークリニック創立者
医学博士
一般社団法人国際個別化医療学会理事長
がん免疫療法は近年大きな注目を集めていますが、「○○は良い」「○○は悪い」といった単純な二元論で語られることも多く、一般の方にとっては非常に分かりにくい分野だと感じます。そこで今回は、現実を踏まえた冷静な視点で、がん免疫と免疫療法について改めてご紹介したいと思います。
がん免疫とは
がん免疫とは、私たちの体に備わる「免疫機構」と「がん細胞」との相互作用全般を指します。
例えば、免疫機構ががん細胞をどのように認識・排除するのか、またがん細胞がどうやって免疫から逃れたり、免疫細胞の働きを抑えたりするのか──こうした仕組みを解明する研究の中から生まれた治療法が「がん免疫療法」です。
がん免疫監視機構
私たちの体の中では、毎日数千個の細胞ががん化の一歩手前の状態にありますが、多くは「がん免疫監視機構」により静かに排除されています。
この免疫監視機構は、体外からの異物や体内で生じた異常細胞を見分けて排除する仕組みで、大きく以下の2つに分けられます。
- 自然免疫:生まれつき備わっている即応型の免疫で、主にNK細胞、マクロファージ、樹状細胞が関与。
- 獲得免疫:異物を学習・記憶して攻撃する免疫で、T細胞やB細胞が関与。
中でもT細胞は、がん細胞表面にある「がん抗原(目印)」を認識してピンポイントで排除するため、がん免疫監視において極めて重要な役割を担います。
がん免疫サイクル
免疫ががんを攻撃する一連の流れを「がん免疫サイクル」と呼びます。その流れを次の①~⑦で説明いたします。
①がん抗原の放出
がん細胞が壊れたりストレスを受けたりすると、がん抗原が体内に放出されます。
②抗原提示
抗原提示細胞(主に樹状細胞)ががん抗原を取り込み、リンパ節に移動。MHCクラスI分子を介してT細胞に、MHCクラスII分子を介してヘルパーT細胞にがん抗原を提示します。
<ポイント>
- リンパ節は免疫細胞同士の情報交換の場です。
- 樹状細胞とヘルパーT細胞の情報交換は、T細胞の活性化を高めます。
- ヘルパーT細胞の関与は、T細胞の十分な活性化に不可欠です。
③T細胞の活性化
提示された抗原を認識したT細胞は活性化し、ヘルパーT細胞の支援を受けてキラーT細胞へと分化・増殖します。
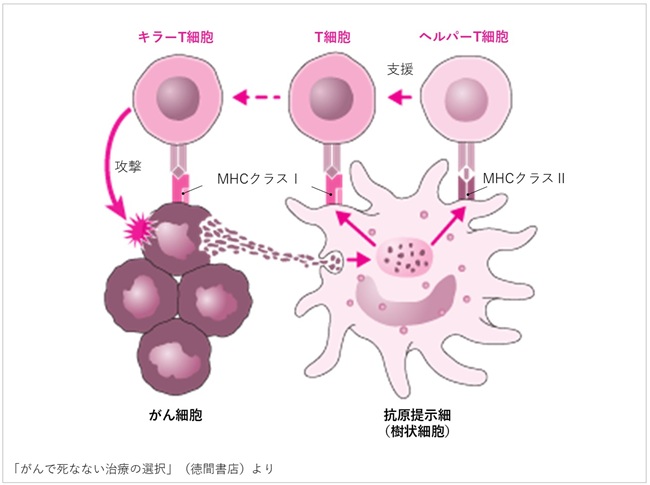
④T細胞の移動(遊走)
活性化したキラーT細胞は血流に乗り、がんのある部位へ向かいます。
⑤がん組織への浸潤
キラーT細胞が血管からがん組織へと入り込みます。
⑥がん細胞の認識
がん細胞表面のMHCクラスIに提示された抗原をキラーT細胞が認識します。
⑦がん細胞の破壊
認識されたがん細胞はアポトーシス(細胞死)へと導かれます。このとき、再びがん抗原が放出され、サイクルが継続します。
このサイクルが繰り返されることで免疫反応は強化・維持されますが、いずれかの段階で途絶えると、がん細胞は免疫から逃れ、がんとして進行してしまいます。
がん免疫療法
がん免疫療法にはいくつか種類があります。代表的な治療法について説明させていただきます。
1. 自己リンパ球療法(LAK療法、TIL療法、NK細胞療法)
1-1. LAK療法
1980年代初頭、アメリカ国立がん研究所のスティーブン・ローゼンバーグ博士らのグループによって開発された治療法です。
「体内のリンパ球を活性化させれば、がん細胞に対する攻撃力が強化できるのではないか」という仮説のもと、患者さんの末梢血からリンパ球を取り出して体外で培養し、再び体内に戻すというアプローチが試みられました。
しかし、末梢血中のリンパ球の多くは、抗原提示を受ける前の未熟なT細胞であるため、単に増殖させただけではがん細胞を認識する能力が十分ではなく、期待されたような治療効果は得られませんでした。
そのため、ローゼンバーグ博士らは、次に述べるTIL療法など、より高度な免疫細胞の活用を目指す研究へと移行していきました。
1-2. TIL療法
TIL療法(腫瘍浸潤リンパ球療法)は、手術などで摘出したがん組織の中から、がんに反応して集まったキラーT細胞(腫瘍浸潤リンパ球)を取り出し、体外で活性化・増殖させてから体内に戻す治療法です。
患者さん自身のがん組織を使うため、その患者さんのがん細胞特有の「目印(がん抗原)」を認識するT細胞を利用することができ、高い治療効果が期待されています。まさに究極の個別化医療とも言える方法です。
一方で、治療に使用するためには、十分量のがん組織を手術で採取する必要があり、さらに高度な細胞培養技術と高コストが伴うため、実施できる施設は限られています。
1-3. NK細胞療法
NK細胞は、生来がん細胞やウイルス感染細胞を識別・攻撃する能力を備えた免疫細胞で、T細胞のように樹状細胞からの抗原提示を必要としません。
この療法では、患者さんの末梢血からNK細胞を取り出し、体外で活性化・増殖させて体内に戻します。
前述の「がん免疫サイクル」では、キラーT細胞がMHCクラスI分子に提示されたがん抗原を認識して攻撃する仕組みでした。しかし、がん細胞の中には、MHCクラスI分子の発現を低下させたり、隠したりすることでT細胞からの攻撃を逃れるものがあります。
このような場合にNK細胞が重要な役割を果たします。NK細胞は、MHCクラスIの発現が低い細胞を異常とみなして攻撃するため、T細胞が見逃すがん細胞を認識・攻撃することが可能です。
ただし、逆にMHCクラスI分子をしっかり発現しているがん細胞に対しては、「正常細胞」と誤認して攻撃しないという欠点があります。また、T細胞のように抗原を学習・記憶する性質がないため、再発防止効果は期待できないとされています。
現在、NK細胞療法は自由診療として提供されていますが、十分な細胞数を得るためには高度な培養技術が必要で、コスト面でも課題があります。実施医療機関では予後調査などを行っている例もありますが、大規模な治験は行われていないため、客観的エビデンスは乏しいと言われています。
2. 樹状細胞ワクチン療法
樹状細胞ワクチン療法は、がん免疫応答の出発点である「抗原提示」という重要なプロセスに直接介入する治療法です。獲得免疫系の免疫応答の質を意図的に働きかけることを目指す点で、他の免疫細胞療法と一線を画すと言えます。
この治療では、患者さんの末梢血から単球を取り出し、体外で未熟な樹状細胞へと分化させます。次に、摘出したがん組織を溶解したもの、または、人工ペプチドなどのがん抗原を加えて培養します。この過程で、樹状細胞にMHCクラスIおよびクラスII分子を介して抗原を提示させます。
完成したワクチン(抗原を提示する樹状細胞)は、皮内または腫瘍内に投与されます。体内に戻された樹状細胞がT細胞に抗原を提示し、ヘルパーT細胞の支援を受けて、キラーT細胞となり活性化されます。活性化されたキラーT細胞は血流に乗ってがん細胞を探し出し、攻撃します。
現在、この治療法は自由診療として提供されています。しかし、以下のようなケースでは期待される治療効果が得られにくいとされています。
- 抗がん剤治療などにより、体内のT細胞数が少ない場合
- がん細胞が、樹状細胞が提示するがん抗原をもたない場合
- がん細胞が、MHCクラスI分子の発現を失っている場合
- 免疫チェックポイントによってキラーT細胞の働きが抑制されている場合
このような課題に対し、NK細胞療法との併用が有効とされることもあります。また、免疫チェックポイント阻害剤との併用も今後期待されるところです。
一方、治療には高度な製造技術が必要で、培養日数とコスト面でも課題があります。
3. CAR-T細胞療法、TCR-T細胞療法
CAR-T細胞療法およびTCR-T細胞療法は、患者さん自身のT細胞を遺伝子改変して、がん細胞を攻撃する能力を高めたうえで体内に戻す、いわゆる遺伝子改変型免疫細胞療法です。どちらの治療法も、ウイルスベクター(主にレンチウイルス)を用いて、T細胞にがんを標的とする情報を付加します。
3-1. CAR-T細胞療法
CAR-T細胞療法は、T細胞に「キメラ抗原受容体(CAR)」という人工の受容体を発現させる治療法です。このCARは抗体の一部を基に設計されているので、抗体と同様にMHC分子によるがん抗原の提示を必要とせず、がん細胞表面の抗原を直接認識して攻撃できるのが特徴です。
とくに、CD19陽性のB細胞性白血病やリンパ腫などの血液がんにおいては高い奏効率を示し、長期寛解例も報告されています。
一方で、以下のような課題もあります。
- 副作用の重篤性:
サイトカイン放出症候群や神経毒性などが報告されており、専門施設での厳重な管理が必須です。 - 標的の限界:
現時点では、認識できる抗原は原則1種類に限られ、多様ながん細胞への応用には限界があります。 - 高コストと製造負担:
細胞加工の複雑さにより、治療費用も高額です。 - MHC依存性:
がん抗原がMHCクラスIに提示されている必要があるため、がん細胞側での抗原提示機構が失われていると効果を発揮できません。 - HLA型による制限:
MHCクラスI分子はHLA型により異なるため、患者さんのHLA型に合致した抗原でなければ使用できません。 - 標的の単一性と多様性への限界:
CAR-Tと同様、標的とする抗原は基本的に1種類のため、がん細胞の多様性への対応に課題があります。 - 自己免疫的副作用:
強い免疫反応によって、正常な細胞を攻撃してしまうリスクもあります。 - 奏効率に限界がある:
特定のがん種では、奏効率(治療に反応する割合)が20〜30%程度にとどまることもあり、誰に効くのかを事前に正確に予測することは難しいとされています。バイオマーカーなどを用いた予測法の開発が進められています。 - 免疫関連の副作用が多い:
PD-1やPD-L1、CTLA-4などのチェックポイント分子は正常な細胞にも広く発現しているため、治療によって過剰な免疫反応が引き起こされ、自己免疫性の副作用が高い頻度で報告されています。副作用の症状は軽いものから重篤なものまで多岐にわたり、多臓器に及ぶ可能性があるため、治療中の慎重なモニタリングが不可欠です。 - 医療財政への影響:
免疫チェックポイント阻害薬は薬剤費が非常に高額であり、今後さらに保険適用が拡大した場合、国の医療財政に与える負担が懸念されています。治療のコストと効果のバランスを考慮し、医療資源をどう配分するかも重要な社会的課題となっています。
3-2. TCR-T細胞療法
TCR-T細胞療法は、T細胞に「T細胞受容体(TCR)」の遺伝子を導入し、特定のがん抗原を認識させる治療法です。TCRはもともとT細胞が持つ受容体であり、MHCクラスIに提示されたがん抗原を認識して攻撃します。
TCR-T細胞は、体内に戻されると抗原提示を経ることなく、即座にがん細胞を認識・攻撃できると考えられています。
しかし、いくつかの制約があります。
今後は、安全性と効果の両立が重要な課題とされており、臨床開発が進められています。
4. 免疫チェックポイント阻害剤
免疫チェックポイントとは、免疫反応が過剰にならないように制御する仕組みであり、免疫の過剰な活性化により健康な細胞を攻撃するのを防ぎ、体内の免疫バランスを保つ重要な役割を果たしています。
しかし、がん細胞はこの免疫チェックポイントの仕組みを逆手に取り、免疫細胞の攻撃から逃れることがあります。
免疫チェックポイント阻害剤は、免疫の働きにブレーキをかけていた仕組みを止め、T細胞が再びがん細胞を攻撃できるようにする治療法です。
現在、使用されている主な薬剤は、PD-1阻害剤、PD-L1阻害剤、CTLA-4阻害剤があります。
これらは、すべてのがんに対して有効というわけではありませんが、効果が認められたがん種では健康保険が適用されており、がん治療に革新をもたらしました。
一方で、いくつかの課題も指摘されています。
最後に
免疫は、ウイルスなどの外敵や体内で発生する異常な細胞と闘うだけでなく、「自分自身」とも常にバランスを取りながら働いている、生体の中でも極めて動的で柔軟なシステムです。
そのため、わずかな介入や変化があるだけでも、免疫のネットワーク全体が再構築されることがよくあります。
これは、免疫が人為的に“都合よく”コントロールできるものではないという、生体のしたたかさと賢さの表れとも言えるでしょう。
だからこそ、がんや病原体とのせめぎ合いの中で、「免疫を完全に制御する」のではなく、本来のバランスに戻すために、免疫の力を少しだけ借りるという発想が重要だと考えています。
がん免疫療法とは、まさにその「免疫の力を借りる」治療です。
免疫が関与するということは、その人自身の年齢、体質、腸内細菌叢、生活習慣、環境、遺伝的背景など、あらゆる要素が治療効果に影響しうるということでもあります。
例えば最近、2025年7月に発表された Nature の報告では、腸内細菌「YB328」を有するマウスや一部のヒトにおいて、免疫チェックポイント阻害薬の効果が高まる傾向が見られたとされ、大きな話題となりました。
このように、免疫療法の成果は薬そのものだけでなく、体内の微生物環境や個体差とも密接に関係しているのです。
つまり、患者さん一人ひとりが異なる条件を持っている以上、「誰にでも効く治療」を目指すこと自体に限界があるのです。
したがって、「何が良い、何が悪い」といった単純な二元論では語れないのが、がん免疫療法の現実です。
重要なのは、それぞれの治療法の長所と短所を冷静に見極めたうえで、その患者さんにとって最適な治療法、または治療の組み合わせを検討するという姿勢です。
がん免疫療法は、決して魔法の治療ではありませんが、「免疫」という本来私たちの体に備わる力を活かす、非常に奥深く可能性に満ちたアプローチであることは間違いありません。
今後の科学的知見の蓄積と、臨床現場での冷静な実践によって、より多くの人にとって有益な治療となることを期待しています。
東京 九段下 免疫細胞療法によるがん治療
免疫療法の東京キャンサークリニック
tokyocancerclinic.jp
〒102-0072 東京都千代田区飯田橋1丁目3-2 曙杉館ビル9階
TEL:0120-660-075


