2000年に入り私たちは免疫機構に着目しがん治療応用へと地道に研究を続けるなか、最初に開発したのは「NK細胞を大量に増殖させ、高活性化させる」技術でした。
NK細胞は、他の細胞の指令を受けたり学習・記憶もすることなく、がん細胞などの異物を発見すると攻撃を仕掛けるので、活性化したNK細胞を大量に投与することで、副作用もなく効果的にがん細胞をたたくことができました。しかし、NK細胞だけでは片手落ちです。
なぜなら、NK細胞だけではがん細胞の多様性に対応することができません。がん細胞を特異的に攻撃するキラーT細胞を大量に作り出す必要がありました。
だからと言って、単にT細胞を大量に培養して体に戻しても、意味がないことがわかっていました。
がんを特異的に攻撃するキラーT細胞を作り出すには、免疫の司令塔と言われる樹状細胞の存在が不可欠だからです。
樹状細胞の優位性は1973年にラルフ・スタインマン博士により報告されており、1974年にはロフル・ツィンカーナーゲル博士とピーター・ドハーティ博士により、MHC拘束性の発見がありました。1991年にテリー・ブーン博士等により、ヒトT細胞が認識するがん抗原MAGE-1の発見で特異的免疫によるがん治療の研究が始まりました。1996年には赤川清子博士により、単核球から樹状細胞の培養方法が発明され、その正当性や安全性が確認されたことで、樹状細胞の培養技術が確立しました。
そして2007年、私たちは樹状細胞を体外で培養しワクチ化して体内に戻すことで、体内のT細胞が活性化し、キラーT細胞となってがん細胞を特異的に攻撃する技術を導入しました。

樹状細胞と獲得免疫におけるその役割の解明の研究に大きな功績を挙げ、2011年ノーベル医学生理学賞を受賞したラルフ・スタインマン教授
なんとか患者さんの負担を減らすことができないか
当時、患者さまが長時間にわたりベッドに横になり、樹状細胞ワクチンを製造するために必要な成分採血(アフェレーシス)をする姿を目の当たりにしてきた医師、阿部博幸が、心の底から抱いた「なんとか患者さんの負担を減らしたい」という想いこそが、革新的な技術を創出し、今日の多価樹状細胞ワクチンの誕生につながることになるのです。
アフェレーシスとは、全身を循環する約5000mlの血液を人工透析のように体外に循環させ、遠心分離機を通して単球を取り出して、再び体内に戻すという採血方法です。
単球は血液のなかに3~9%ほどなので、樹状細胞ワクチンの治療として充分な量の単球を得るには、2~5時間かけてアフェレーシスを行わなければならないのです。
体力気力とも充分な方でしたら、なんとか我慢していただけますが、QOLが低下しているような患者さまには心身ともに非常に負担を強いるものとなります。
機械から戻る血液は冷たいため体が冷えてしまい、アフェレーシス後に気分が悪くなる患者さまも少なくありませんでした。抗がん剤などでボロボロになった血管の方、浮腫でパンパンに腫れている方は、ルートを確保することがとても困難なこともありました。アフェレーシスを行うことは医療スタッフにとっても大きな負担となっていました。
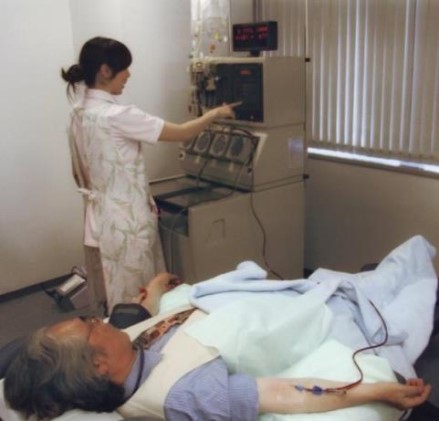
アフェレーシスの様子
アフェレーシスをすることなく、樹状細胞ワクチンを作りたい
こうして研究がスタートしました。
そもそも樹状細胞ワクチンを製造するのに、なぜ単球が必要なのでしょうか。
それは、樹状細胞は血液中にはほとんど存在しないため、リンパ球の一種である単球を血液から取り出し、樹状細胞へと分化させる必要があるからです。
従って、樹状細胞ワクチンを製造するためには、まず、患者さまの単球を得る必要があるのです。
アフェレーシスの場合は、得た単球の数=樹状細胞の数となります。そのために、樹状細胞ワクチンの治療として充分な量の単球を得るために、一度に2~5時間かけておよそ約200ml近くの単核球の成分採血を行うのです。そして、ここで得られた単球の数によりますが、およそ5~7本分の樹状細胞ワクチンを一度に製造し凍結保存をすることになります。患者さまの状態によっては単球の数を十分確保することが出来ないこともあり、必然的にワクチンの質や量に影響します。
樹状細胞ワクチン製造の全行程を見直し、刷新へ
私たちの研究部門のスローガンは「Less is More(より少ない方がより豊か)」。
転じて、「患者さまのより少ない負担で、より良い治療成績を」を掲げることで、結局、樹状細胞ワクチン製造のすべての工程を見直すことになったのでした。
臨床医でもある阿部博幸を中心に研究部門のスタッフが一丸となり、試行錯誤を繰り返し研究を続け、ついに世界に誇れる革新的な樹状細胞ワクチンの製造方法を確立することに成功しました。
画期的なポイントのいくつかをご紹介します。
単球を未分化のまま増殖させる技術
患者さまの少ないサンプル(血液)から大量の単球を得るために、単球を未分化のまま増殖させる技術を開発しました。この技術により、わずか25mlの静脈採血から、樹状細胞ワクチン1本分に治療に充分な量の単球を得ることが可能になりました。
単球未分化増殖技術のメリットはたくさんあります。
- アフェレーシスが不要
- 少ないサンプルでいい
- 単球が少ない人でも治療が可能
- 凍結解凍の必要がなく生細胞率の高い
こうして、樹状細胞ワクチンの治療を受けるにあたり、患者さまの心身的負担が大幅に軽減されるようになりました。

完成したワクチン
この中に1×107個以上の樹状細胞が入っていいます。生細胞率は97%以上
単球から未熟な樹状細胞へ分化させる技術
樹状細胞は未熟な状態でペプチドを取り込むことで、細胞内で処理し、抗原を提示します。樹状細胞ワクチンを製造する上で、ここはとても重要なポイントです。
私たちはオリジナル培地を使用して、未熟な状態の樹状細胞へ分化させる技術を確立しました。
4種類以上のペプチドを使用
“多価”樹状細胞ワクチンの時代になりました
樹状細胞ワクチン製造において、どのようなペプチドを使用するかが、ワクチンとしての真価が問われる重要な要素のひとつになります。
一般的に樹状細胞ワクチンで使用するペプチドはWT1やMUC1などを1~2種類で、長さも短いショートペプチドと言われるものです。もしくは手術でがん組織を保管できた場合は、自己がんをライセートとして使用することもあります。
WT1は、“ほとんどのがん細胞に発現しているペプチド” として注目されています。すると、どんながんの人でもWT1さえ使用すれば大丈夫、と考えたいところですが、がん細胞は一筋縄ではいきません。
がん細胞の多様性は最近よく知られるようになってきました。
がん細胞は何種類もの目印(ペプチド/がん抗原)をもっていますが、がん細胞によっては目印を何種類も発現しているもの、目印のいくつかを隠してしまっているもの、全ての目印を隠してしまっているものなど実に様々です。
注目のWT1を使っても、がん細胞がWT1の目印を隠してしまっていたら、がん細胞を攻撃できません。従って樹状細胞ワクチン製造において大切なことは、その人のがん細胞に適合するペプチドを出来るだけたくさん使用することです。
そこで私たちは、攻撃目標をできるだけ多くするために、4種類~8種類のペプチドを未熟な樹状細胞に取り込ませる技術を確立しました。多価樹状細胞ワクチンとして、がんの多様性に対応するようになりました。
オーバーラップさせた長鎖ペプチドを使用
ペプチドの長さもとても重要
スタインマン博士も「樹状細胞をターゲットにしたタンパクをパルスしたワクチンのような新しいチャレンジが必要である。タンパク(および長鎖ペプチド)ワクチンは媒体の免疫を引き出すこともなく、抗原の競合も起こらない。」と、2010年に行われたForum on Vaccine Scienceでお話しされていたように、ペプチドの長さも大変重要なポイントになります。
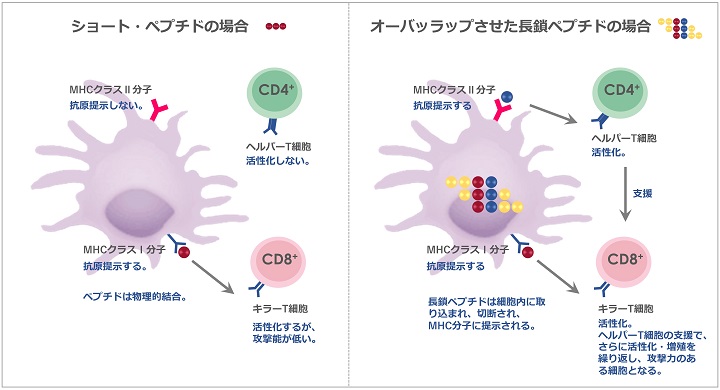
一般的には9~13個のアミノ酸から成る「ショートペプチド」が使われています。
ショートペプチドの場合、樹状細胞のMHCクラスI分子に物理的に結合するに過ぎずません。この場合、樹状細胞からT細胞に抗原提示が行われるものの、活性化に必要な十分な副刺激が与えられず、結果的に標的細胞を十分に攻撃できないことが分かってきました。
また、ショートペプチドではMHCクラスII分子にペプチドが発現しないので、ヘルパーT細胞も活性化しません。ヘルパーT細胞は、活性化したキラーT細胞がさらに活性化・増殖を繰り返し攻撃力のある細胞になるために、大変重要な役割を担っています。
私たちはこの問題を解決するために、13個以上のアミノ酸から成る長鎖ペプチドをオーバーラップさせたものを使用することにしました。
長鎖ペプチドの優れているところは、HLAに関係なく、どなたでもご自身のがん細胞に適合するペプチドが使えることです。
樹状細胞が細胞内に長鎖ペプチドを取り込み、処理して MHCクラスI分子とMHCクラスII分子上に提示させます。これは、ショートペプチドで見られる物理的結合とは違います。
このペプチドを使用することで、キラーT細胞のみならず、ヘルパーT細胞も活性化します。
活性化したキラーT細胞は分裂増殖していきます。この過程で細胞内にパーフォリンやグランザイムといった標的細胞を攻撃する物質をもつ、「エフェクター細胞」と呼ばれるものになっていくのです。
オーバーラップした長鎖ペプチドを使用することで、HLAに拘束されることなく、誰でも様々なペプチドを使用した、強力な樹状細胞ワクチンを受けられるようになりました。
このように、樹状細胞ワクチン製造に関わるすべての工程を見直すことで、画期的な多価樹状細胞ワクチンが誕生しました。
この樹状細胞ワクチン製造に関わる一連の特許を日本と米国で取得したのを機に、その独自性を示すために、エイビーバックス®(ABeVax®)と名付けました。
ABeVaxとは、抗がん作用があり、樹状細胞のMHCクラスIとMHCクラスIIの双方にペプチドを提示するワクチンを意味する、Anticancer Binary Epitope Vaccineに由来した造語です。
エイビーバックス-多価樹状細胞ワクチンの完成は私たちのゴールではありません。
患者さまにより良い医療を提供するために、今も私たちは新たな開発に向けて挑戦が続いています。
阿部博幸研究チーム 免疫療法の臨床・研究ヒストリー
| 2002年 | NK細胞療法開始 |
|---|---|
| 2007年 | 樹状細胞ワクチン療法開始 |
| 2009年 | リンパ球の活性・増殖に係る培養方法で特許を日本で取得(特許第4275680号) |
| 2013年 | 海外企業と新ペプチドと樹状細胞ワクチンの共同臨床研究契約を締結 |
| 2014年 | 樹状細胞ワクチン製造に係る一連の特許を日本で取得(特許第5577472号) |
| 2015年 | ハイブリット免疫療法関連の特許を日本で取得(特許第5856025号) 再生医療関連技術の特許を日本で取得(特許第5856029号) |
| 2016年 | 樹状細胞ワクチン製造に係る一連の特許を米国で取得(米国特許US9303247 B2) 樹状細胞ワクチン製造に係る一連の特許をドイツ・フランス・イギリスで取得(欧州特許EP2749639 B1) 樹状細胞ワクチン製造に係る一連の特許を韓国で取得(韓国特許第10-1680164号) 単核球を複数の免疫細胞へ分化増殖する技術の特許を日本で取得(日本特許第5997296) |
| 2017年 | 樹状細胞ワクチン製造に係る一連の特許をシンガポールで取得(シンガポール特許SG11201404570W) 樹状細胞ワクチン製造に係る一連の特許を台湾で取得(台湾特許第I607017号) ハイブリット免疫療法関連の特許を韓国で取得(韓国特許第10-1732532号) 再生医療関連技術の特許をカナダで取得(カナダ特許2872852) 再生医療関連技術の特許を米国で取得(米国特許US9670461 B2) 再生医療関連技術の特許を韓国で取得(韓国特許第10-1813269号) |
| 2018年 | 単核球を複数の免疫細胞へ分化増殖する技術の特許を台湾で取得(台湾特許第I612137号) ハイブリット免疫療法関連の特許を米国で取得(米国特許US10,113,148 B2) 単核球を複数の免疫細胞へ分化増殖する技術の特許を韓国で取得(韓国特許第10-1923848号) 樹状細胞ワクチン製造に係る一連の特許を中国で取得(中国特許CNZL201380001273.1) 再生医療関連技術の特許をドイツ・イギリス・イタリアで取得(欧州特許2891713) 単核球を複数の免疫細胞へ分化増殖する技術の特許を米国で取得(米国特許US10,160,952 B2) |
| 2019年 | 樹状細胞ワクチン製造に係る一連の特許をマカオで取得(マカオ特許MOJ/003584) 再生医療関連技術の特許を中国で取得(中国特許ZL201380033421.8) 樹状細胞ワクチン製造に係る一連の特許を香港で取得(香港特許HK1194101) |
| 2020年 | ハイブリット免疫療法関連の特許をドイツ・イギリス・フランス・イタリア・スイスで取得(欧州特許2881462) 再生医療関連技術の特許を香港で取得(香港特許HK1205187) ハイブリット免疫療法関連の特許を中国で取得(中国特許ZL201380034962.2) ハイブリット免疫療法関連の特許をカナダで取得(カナダ特許2876260) 単核球を複数の免疫細胞へ分化増殖する技術の特許をドイツ・イギリス・フランス・イタリア・スイスで取得 (欧州特許2947144) |
2021年 | ハイブリット免疫療法関連の特許を香港で取得(香港特許HK1204655) |
